抱歉,我們並不支援你正使用的瀏覽器。
為達至最佳瀏覽效果,請更新至最新的瀏覽器版本。
如有問題,歡迎電郵至 pccwmediaiapps@pccw.com 查詢。
為達至最佳瀏覽效果,請更新至最新的瀏覽器版本。
如有問題,歡迎電郵至 pccwmediaiapps@pccw.com 查詢。
廣告
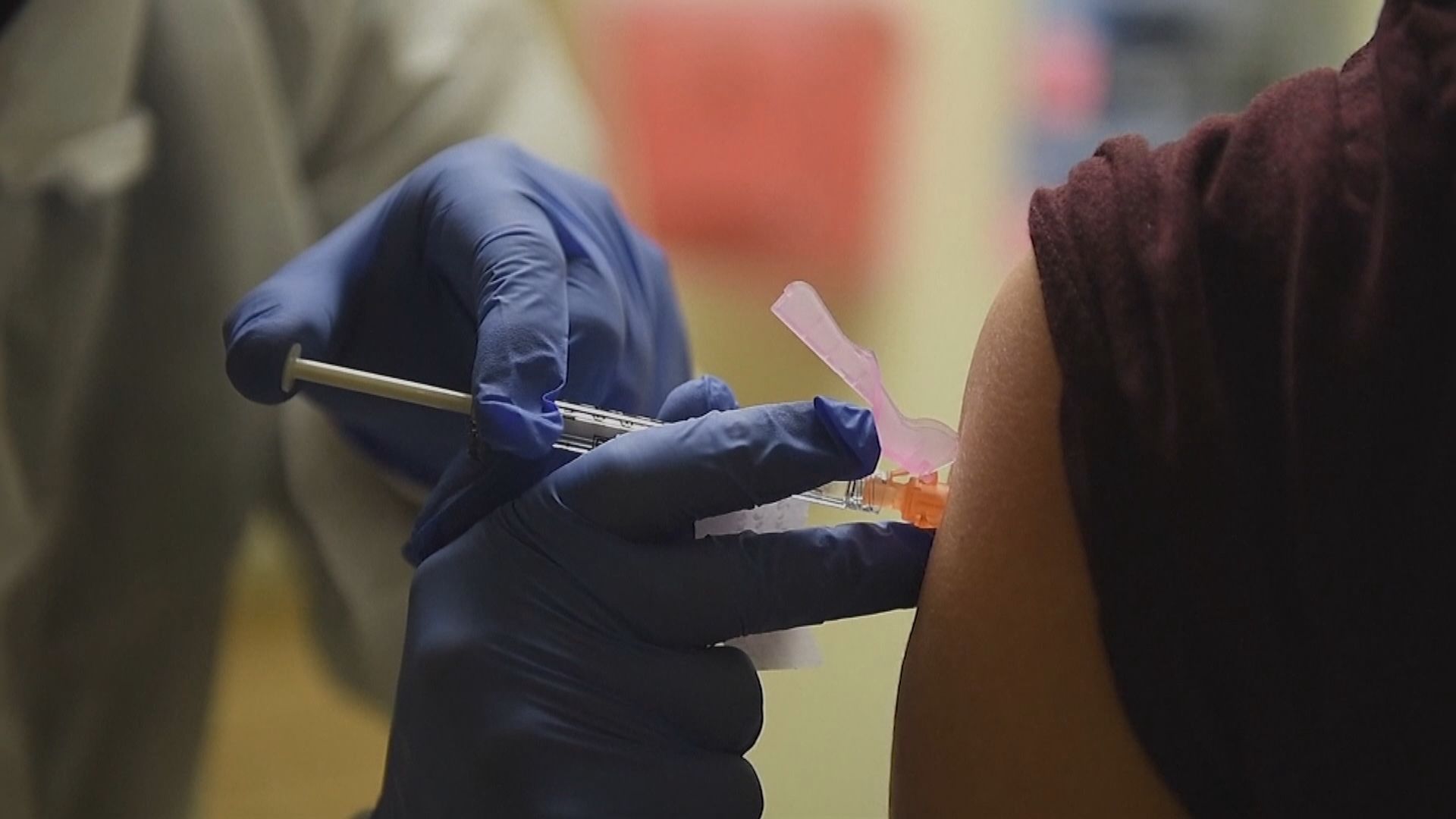
【Now新聞台】美國藥廠輝瑞正式申請緊急授權使用其研發的新冠疫苗,當局已安排下月十日召開顧問會議,與外間專家商討是否批准疫苗供公眾接種。
輝瑞行政總裁艾伯樂:「我感到很驕傲和喜樂,甚至有點鬆一口氣。」
美國藥廠輝瑞正式向美國食品及藥物管理局申請緊急授權使用,與德國藥廠BioNTech共同研發的新冠疫苗,是首款遞交有關申請的新冠疫苗。
食藥局表示會盡快審批輝瑞的申請,但未能預計需時多久,若申請獲批,預料輝瑞下月就能向美國提供2500萬劑疫苗,到年底可向全球供應五千萬劑。
總統特朗普表示,輝瑞研發疫苗步伐如此快,他有功勞。
特朗普:「你不會有疫苗,若不是我在任多四年,因為食藥局永無法做到他們(藥廠)所做的,我迫他們(藥廠)所做的。」
輝瑞和BioNTech早前表示,他們的新冠疫苗有效率達九成五,這些聲稱有幾準確呢?
食藥局收到申請後,其醫療、病理統計學專家團隊,會鑽研數以千頁藥廠遞交的第三階段臨床試驗原始數據,並發表分析報告,由此外界將略知當局對疫苗的取向。
報告面世約兩日後,會召開顧問委員會會議,雲集局外顧問、傳染病和疫苗界專家,辯論疫苗的安全性和成效,有關公開會議定在12月10日舉行。
會後專家會進行無約束力的投票,建議當局是否通過提供疫苗予公眾注射,以及適合接種的族群,食藥局一般都會跟隨有關建議。
過了食藥局一關後,疾控中心的顧問組會在24至48小時內召開會議,決定誰能優先接種疫苗,預料首批將會是美國約2000萬名醫護人員。
即使獲得緊急授權使用,都不代表疫苗能正式廣泛使用,輝瑞必須繼續其臨床試驗,至少提供六個月以上數據。
美國單日新增約20萬宗確診病例,近日的死亡數字亦創五月以來的新高,遠水不能救近火。傳染病專家福奇表明,民眾應加強公共衛生措施,直至疫苗真正面世。


