抱歉,我們並不支援你正使用的瀏覽器。
為達至最佳瀏覽效果,請更新至最新的瀏覽器版本。
如有問題,歡迎電郵至 pccwmediaiapps@pccw.com 查詢。
為達至最佳瀏覽效果,請更新至最新的瀏覽器版本。
如有問題,歡迎電郵至 pccwmediaiapps@pccw.com 查詢。
廣告
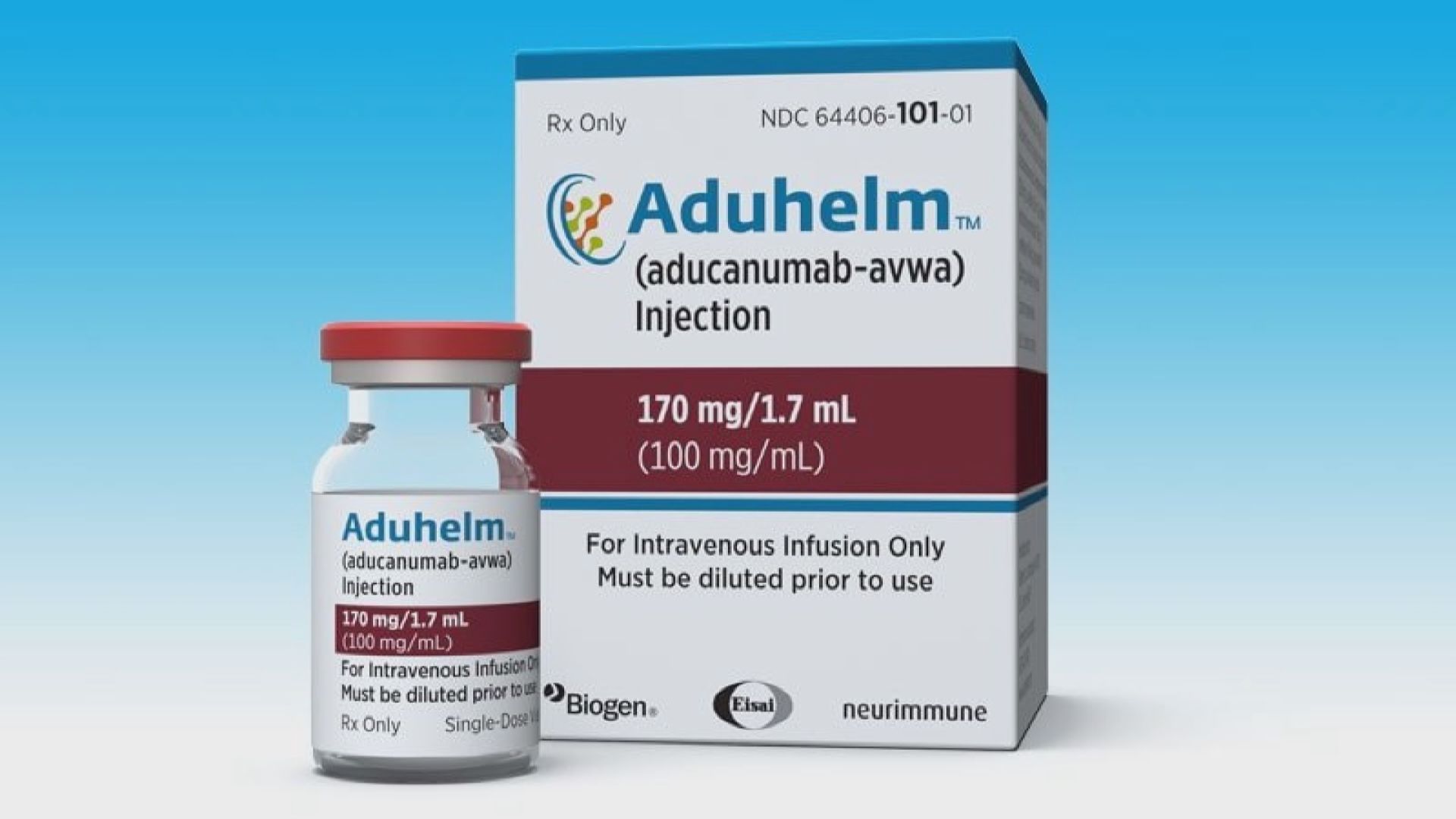
【Now新聞台】美國食品及藥物管理局去信衞生及公共服務部,要求聯邦政府調查管理局的審核員,在審批用於治療阿茲海默症的新藥時,與藥廠有否非常不尋常的接觸。
美國藥廠BIOGEN用於治療阿茲海默症的新藥,於6月獲美國食品及藥物管理局批准時引發爭議。
其中一個原因是新藥昂貴,每名病人每年所花的藥費高達5.6萬美元,另一個原因是藥效沒有令人信服的證據。
在質疑聲音不斷下,管理局的專家顧問委員會11名成員中有3人辭職,抗議管理局的決定。
BIOGEN在2019年3月發現兩項臨床測試顯示,新藥在減緩記憶力和思考能力衰退方面,不見得比安慰劑好後叫停測試。根據一個衞生新聞網站的報道,叫停測試後兩個月美國食品及藥物管理局,有審核員和藥廠代表秘密會面,之後管理局和藥廠一起重新分析數據。
管理局代理局長伍德科克周五在社交平台,公開寫給衞生及公共服務部的信件,要求調查在新藥審批過程期間,管理局的審核員有否違規與藥廠進行非常不尋常的接觸。
伍德科克說,提出調查的要求是為了釋除公眾疑慮,她對涉事人員的誠信充滿信心,BIOGEN就稱會配合調查。
管理局近日已更新用藥指引,指這款藥只適用於阿茲海默症的初期患者,而不是所有患者。


